Sommaire
L’Index de Pression Systolique : Détermination et intérêt?
L'index de pression systolique (IPS) peut faire partie de l’examen clinique en étant muni d’un Doppler de poche. Il a deux intérêts : détecter une Artériopathie Oblitérante des Membres Inférieurs (AOMI) le plus précocement possible et indiquer un risque accru de morbi-mortalité cardiovasculaire. En l’absence de symptôme, un IPS < 0,90 signe une AOMI asymptomatique et indique un risque d’accident cardiovasculaire inversement corrélé à sa valeur.
Mis au point il y a plus de 40 ans (1), l’indice de pression systolique (IPS) suscite un regain d’intérêt depuis quelques années. L’IPS est le rapport de la pression systolique à la cheville sur la pression systolique humérale,mesurées à l’aide d’une sonde Doppler de poche (Doppler portable).
Un IPS inférieur à un seuil de 0,90 signe l’existence d’une AOMI, avec une sensibilité de 95 % et une spécificité proche de 100 %.
L’IPS permet de détecter précocement une AOMI
L’intérêt de la mesure de l’IPS est de détecter une AOMI le plus précocement possible à un stade souvent asymptomatique, soit parce que le symptôme “claudication d’effort” ne s’est pas encore extériorisé chez un patient mobile, soit parce que le patient, pas assez mobile, a un périmètre de marche insuffisant pour qu’il se déclenche. La douleur peut aussi ne pas s’exprimer en cas de neuropathie associée (diabétique ou non). Les formes asymptomatiques d’AOMI voient donc leur fréquence augmenter avec l’âge.
LA MESURE DE L’IPS |
|---|
IPS = PAS cheville / PAS humérale : 120 / 150 = 0,80 |
Voir ici la Vidéo : Mesure de la Pression distale
Pourquoi détecter précocement une AOMI ?
Pour mesurer un risque
 Risque local
Risque local
Le niveau de l’IPS est corrélé avec la sévérité de l’artériopathie. Plus il est bas, plus le retentissement de l’AOMI est grave.
 Interprétation clinique de la mesure de l’IPS
Interprétation clinique de la mesure de l’IPS
Détecter une AOMI a donc un intérêt local : par exemple, un patient âgé, qui à la suite d’une pathologie aiguë se trouve alité ou immobilisé, est un sujet dont le risque d’escarre est accru. Pour autant, on ne saurait dramatiser ce risque : à titre d’exemple, moins de 10 % de sujets avec une claudication intermittente feront une ischémie critique dans les 5 ans. À noter qu’un IPS trop élevé(>1,3) a aussi une valeur péjorative. Détecter une AOMI a surtout un intérêt général. Avoir une AOMI témoigne d’une artériosclérose et signe un risque accru de morbi-mortalité cardio et cérébrovasculaire. Cela a été démontré chez les sujets claudicants qui, à 5 ans, ont un risque d’environ 30 % de faire un accident coronarien ou vasculaire cérébral (une fois sur trois létal) (2). Cela a été aussi mis en évidence avec le paramètre IPS. Ainsi, une étude récente sur un suivi de 12 ans de presque 1 600 sujets de 55 à 75 ans a permis de démontrer (3) que plus l’IPS est abaissé, plus la morbi-mortalité cardiovasculaire est élevée. On ajoutera qu’un IPS franchement augmenté (> 1,30) constitue alors un marqueur indépendant de risque cardiovasculaire et a la même valeur péjorative qu’un IPS < 0,90. Pour réduire le risque de morbi-mortalité vasculaire La mise en évidence d’une AOMI indique une morbidité cardio et cérébrovasculaire accrue qui peut être réduite par une trithé,rapie médicamenteuse associant : antiagrégants plaquettaires, statines,Inhibiteurs de l’Enzyme de Conversion (IEC). Dans la pratique, deux situations peuvent s’individualiser. Soit le patient n’avait aucun traitement à visée cardiovasculaire et la trithérapie susmentionnée peut lui être logiquement proposée avec les précautions d’usage. Soit, et c’est plus souvent le cas, il est déjà traité pour une HTA ou une hypercholestérolémie, il sera alors légitime de lui adjoindre un antiagrégant plaquettaire voire une statine s’il n’en avait pas. Quant au traitement antihypertenseur, au cas où l’HTA était insuffisamment équilibrée, l’adjonction d’un IEC au traitement antérieur est logique, en surveillant bien la créatinine lors de la mise en route. Si tel est le cas, on sait que la mise en évidence de la seconde localisation athérothrombotique qu’est l’AOMI double le risque de morbi-mortalité cardiovasculaire. Cela a été démontré par le registre REACH. Pour autant , l’ordonnance d’un patient ayant déjà fait un accident coronarien ou cérébrovasculaire comporte, en règle générale, déjà la triade : antiagrégant-statine-IEC. REGISTRE REACH Il s’agit d’une vaste étude observationnelle mondiale de 55000 patients de plus de 45 ans souffrant d’une maladie athérothrombotique, incluant une cohorte française de 3 514 patients. Sur 1 an de suivi, les patients ayant une atteinte polyartérielle ont eu un taux d’événements cardiovasculaires majeurs à 1 an passant de 11,7 % pour une atteinte athérothrombotique unique à 22,3 % pour deux localisations ou plus. La mise en évidence d’une AOMI doit être un argument de plus en faveur d’une observance sans faille. Mais elle ne modifie pas fondamentalement l’ordonnance à une réserve près : le fait que le praticien puisse être amené à remplacer l’aspirine par du clopidogrel, à la lumière de l’étude CAPRIE (4). S’il s’agit d’un coronarien sous bêtabloquants, la mise en évidence d’une AOMI n’est (contrairement au syndrome de Raynaud) pas une contre-indication à cette classe médicamenteuse. En pratique clinique, deux cas de figure se présentent Soit un écho-doppler artériel est nécessaire • En cas d’ischémie critique révélée par une douleur de décubitus ou un ulcère artériel, l’écho-doppler artériel doit être obtenu en urgence. Il est presque certain en cas d’abolition d’un pouls tibial postérieur, probable/ possible en cas d’abolition d’un pouls pédieux. De toute façon, dès le moindre doute, un écho-doppler des membres inférieurs est réalisé pour confirmer le diagnostic et faire un bilan des lésions artérielles en appréciant leur topographie et en évaluant leur degré de sténose. La mesure de l’IPS est alors demandée à l’opérateur (Elle devrait faire partie de tout examen des membres inférieurs...). Elle confirmera le diagnostic et contribuera à apprécier le degré de gravité de l’ischémie (surtout en cas d’ischémie critique). Soit un écho-doppler artériel ne s’impose pas Le patient est asymptomatique et l’examen clinique des trajets vasculaires ne révèle aucune anomalie. Pour autant, et même s’il s’agit d’un patient mobile sans claudication, une AOMI asymptomatique est possible. Comme de nombreuses pathologies, la prévalence de cette pathologie augmente avec l’âge. On estime que l’AOMI concerne plus de 10 % des personnes de plus de 70 ans et plus de 20 % des personnes âgées de plus de 75 ans. Faut-il pour autant dépister systématiquement l’AOMI chez toute personne âgée et, si oui, à partir de quel âge ? Il n’y a en l’état actuel de nos connaissances aucun argument en faveur d’un dépistage systématique par le praticien, muni d’un Doppler de poche permettant l’évaluation de l’IPS. Il est toutefois possible de raisonner en termes de populations à risque. Quand le praticien peut-il mesurer l’IPS ? Dans le cadre d’une hospitalisation Détecter une AOMI de principe apparaît utile chez les patients âgés hospitalisés quelle que soit la cause. On peut ici se référer à l’étude ELLIPSE qui a trouvé près de 42 % de patients âgés hospitalisés avec un IPS pathologique. On peut donc imaginer que l’utilisation du Doppler de poche puisse être systématisée au cours de l’hospitalisation de tout sujet âgé. ÉTUDE ELLIPSE Et en ambulatoire ? Détecter de principe une AOMI en suivi ambulatoire apparaît raisonnable chez des sujets : • ayant un antécédent coronarien ou cérébrovasculaire, ce qui est étayé par le registre REACH qui retrouve une AOMI chez plus d’un quart des coronariens et plus d’un tiers des cérébrovasculaires ; En conclusion L’examen clinique, en particulier chez la personne âgée, est souvent grevé de faux négatifs. La technologie vient souvent au secours du médecin en proposant des “mini examens complémentaires au lit du patient” qui constituent un véritable prolongement de l’examen clinique : ECG, glycémie capillaire, bandelette urinaire, saturomètre... Le Doppler de poche évaluant l’IPS est un autre exemple de ces examens très utiles qui pourraient être plus souvent réalisés. Références 1. Carter SA, Lezak JD. Digital systolic pressures in the lower limb in arterial disease. Circulation 1971 ; 73 : 905-914. D’après un article du Dr Y. KAGAN (Fondation Rothschild) publié en ligne par le Journal International de Médecine. Risque surtout général
Risque surtout général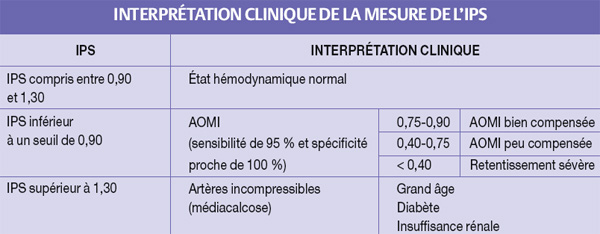
 Il n’existe pas d’autre localisation athérothrombotique connue
Il n’existe pas d’autre localisation athérothrombotique connue Le patient a déjà une autre localisation athérothrombotique connue
Le patient a déjà une autre localisation athérothrombotique connue Le patient a déjà une autre localisation athérothrombotique connue
Le patient a déjà une autre localisation athérothrombotique connue Dans trois types de situations
Dans trois types de situations
• En cas de claudication intermittente, le diagnostic d’AOMI est quasiment un diagnostic d’interrogatoire, les claudications neurologiques ayant une autre sémiologie.
• En cas d’examen clinique anormal des trajets vasculaires, le diagnostic d’AOMI est sûr ou probable. Il est certain s’il existe un souffle vasculaire (iliaque ou fémoral), un anévrisme ou une abolition d’un pouls fémoral. Le patient a déjà une autre localisation athérothrombotique connue
Le patient a déjà une autre localisation athérothrombotique connue La détermination de l’IPS est alors effectué par l’exminateur
La détermination de l’IPS est alors effectué par l’exminateurCette étude épidémiologique, observationnelle, multicentrique, menée en France sur 6 mois en 2007 sur plus de 2 000 malades hospitalisés tout venants de plus de 55 ans et d’âge moyen 73 ans et sans AOMI connue a trouvé 42 % de sujets avec un IPS < 0,90 (4 % avec un IPS < 0,50, 12 % avec un IPS entre 0,50 et 0,70, 26 % avec un IPS entre 0,70 et 0,90), et 3 % de sujets avec un IPS ≥ 1,30.
• ayant au moins un facteur de risque vasculaire connu comme une HTA ou une hypercholestérolémie et avec une mention particulière pour le tabagisme et un diabète évoluant depuis une dizaine d’années ;
• ayant une neuropathie périphérique (diabétique en tête) qui peut abolir toute douleur d’effort.
2. Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG; on behalf of the TASC Il Working Group. Inter-Society consensus for the management of peripheral arterial disease (TASC II). J Vasc Surg 2007 ; 45(Suppl 1) : S 5-67.
3. Lee AJ et al. Improved Prediction of Fatal Myocardial Infarction Using the Ankle Brachial Index in Addition to Conventional Risk Factors. The Edinburgh Artery Study. Circulation 2004 ; 110 : 3075-3080.
4. CAPRIE STEERING COMMITTEE. A randomized, blinded trial of Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events (CAPRIE). Lancet 1996 ; 348 : 1329-1339.
Sommaire | Page Informations | Haut de la Page |